Hace más de 30 años, el Congreso aprobó, por amplia mayoría, una ley de salud histórica, dirigida a motivar a las compañías farmacéuticas a desarrollar nuevas drogas para personas cuyas enfermedades raras habían sido ignoradas.
Según los cálculos de las farmacéuticas, los mercados para esas enfermedades no eran lo suficientemente grandes como para preocuparse por ellos.
Pero lucrativos incentivos financieros creados por la Ley de medicamentos Huérfanos (Orphan Drug Act), firmada por el presidente Ronald Reagan en 1983, tuvo éxito más allá de cualquier expectativa. Más de 200 compañías han puesto en el mercado casi 450 “drogas huérfanas” desde que la ley entró en vigencia.
Sin embargo, una investigación de Kaiser Health News (KHN) muestra que el sistema destinado a ayudar a los pacientes desesperados está siendo manipulado por las farmacéuticas para maximizar los beneficios y proteger los nichos de mercado de los medicamentos que ya están consumiendo millones de personas. Las empresas no están violando la ley, pero la están utilizando para su beneficio en formas que sus creadores, dicen, no preveían ni pretendían. Hoy en día, muchos medicamentos huérfanos, originalmente desarrollados para tratar enfermedades que afectan a menos de 200.000 personas, tienen precios astronómicos.
Y muchas drogas que ahora tienen estatus de “huérfanas” no son completamente nuevas. Más de 70 de estas drogas ya fueron aprobadas por la Administración de Drogas y Alimentos (FDA) para uso en el mercado masivo. Estos medicamentos, algunos con nombres de marca familiares, fueron aprobados más tarde como huérfanos. En cada caso, sus fabricantes recibieron millones de dólares en incentivos gubernamentales, además de siete años de derechos exclusivos para tratar esa enfermedad rara. Es decir, un monopolio.
Los fabricantes consiguieron que fueran calificadas como huérfanas, drogas que ya eran populares en el mercado masivo como Crestor, el exitoso tratamiento para el colesterol; Abilify, para condiciones psiquiátricas; la droga para el cáncer Herceptin, y Humira, para la artritis reumatoide, el medicamento más vendido en el mundo.
Otras 80 drogas huérfanas obtuvieron la aprobación de la FDA para más de una enfermedad rara, y en algunos casos, múltiples de estas enfermedades. Por cada aprobación adicional, la farmacéutica calificó para un nuevo paquete de incentivos. Botox, almacenado en la mayoría de las oficinas de los dermatólogos, comenzó como una droga para tratar espasmos musculares dolorosos del ojo y ahora tiene tres aprobaciones como fármaco huérfano. También se aprobó como medicamento en el mercado masivo para tratar una variedad de dolencias, incluyendo migrañas crónicas y arrugas.
En conjunto, la investigación de KHN encontró que cerca de un tercio de las aprobaciones de la FDA de drogas huérfanas desde el inicio del programa han sido fármacos de consumo masivo reutilizados como huérfanos, o drogas que recibieron múltiples aprobaciones como huérfanas.
“Lo que estamos viendo es un sistema creado con buenas intenciones que está siendo bastardeado”, dijo Bernard Munos, ex asesor de estrategia corporativa del gigante farmacéutico Eli Lilly and Co., quien revisó el análisis de KHN de varias bases de datos de drogas de la FDA. Es “muy notable que esto haya durado tanto tiempo”.
Y la proporción de nuevos medicamentos aprobados como huérfanos ha aumentado. En 2015, se aprobaron 21 medicamentos huérfanos, que representaron el 47% de todos los nuevos medicamentos, frente a sólo el 29% en 2010. En 2016, obtuvieron aprobación otros nueve huérfanos, el 40% del total.
Cuando una farmacéutica gana la aprobación de un medicamento para una enfermedad rara, la compañía obtiene siete años de derechos exclusivos para el mercado. Esto significa que la FDA no aprobará otra versión para tratar esa enfermedad rara durante ese lapso de tiempo, incluso si la patente ha expirado. La exclusividad es la compensación por el desarrollo de un medicamento diseñado para un pequeño número de pacientes cuyas ventas totales no se espera que sean rentables.
Pero la exclusividad es una potente herramienta para manejar los precios. Las farmacéuticas pueden cobrar lo que quieran protegiendo su medicina de la competencia. La exclusividad de mercado otorgada por la Ley de Medicamentos Huérfanos puede ser una parte vital del escudo protector que crean las empresas. Es más, los fabricantes pueden volver a la FDA con el mismo fármaco una y otra vez, cada vez que lo prueban contra una otra enfermedad rara.
Los críticos han atacado a los fabricantes de drogas en el pasado por jugar con el proceso de aprobación de medicamentos huérfanos. Pero la medida en que las empresas han estado ganando la aprobación de drogas que no son lo que los defensores llaman “verdaderas huérfanas” no se había documentado hasta la investigación de Kaiser Health News.
Munos dijo estar “sorprendido” por el gran número de drogas masivas que se reutilizaban, así como por las que han sido aprobadas varias veces.
Incluso los funcionarios de la agencia dijeron que no eran conscientes del alcance de la cuestión. Después de revisar los hallazgos de KHN durante dos semanas, la doctora Gayatri Rao, directora de la Oficina de Desarrollo de Productos Huérfanos de la FDA dijo que “apreciaba el trabajo” y expresó interés en estudiar con qué frecuencia las compañías farmacéuticas están “reutilizando” un medicamento para una nueva enfermedad rara o dándole “múltiples mordiscos a la manzana”.
“Vamos a estudiar esto”, dijo, y agregó que podría considerar un cambio regulatorio.
Rao señaló que cambiar el propósito de las drogas tiene beneficios científicos y para el paciente. Por ejemplo, los medicamentos contra el cáncer aprobados para un tipo de malignidad pueden ser probados y aprobados para otros. Gleevec, una droga que revolucionó el tratamiento de la leucemia mieloide crónica, ahora tiene nueve aprobaciones como huérfana.
Pero en un comentario de 2015 publicado en el American Journal of Clinical Oncology, el doctor Martin Makary de la Facultad de Medicina de la Universidad Johns Hopkins se centró en los medicamentos contra el cáncer, incluyendo Gleevec, argumentando que la droga nunca fue pensada para servir a una población huérfana. En su lugar, escribieron Makary y su equipo, los fabricantes de drogas identifican a las pequeñas poblaciones de pacientes para obtener aprobaciones adicionales, un proceso que él describió como “de fraccionamiento”.
“Dividir la enfermedad en subgrupos les permite obtener la aprobación de los medicamentos huérfanos con todos los beneficios del gobierno e incluso algunos de los subsidios”, dijo Makary. Los precios de estos medicamentos a menudo aumentan porque tienen siete años sin competencia para un nuevo conjunto de pacientes, agregó Makary.
La FDA ha adoptado una visión diferente sobre la reutilización.
“Siempre hablamos de cómo permitimos el segundo mordisco de la manzana, el tercer bocado de la manzana, como una pequeña forma de incentivar la reutilización”, dijo Rao, señalando que la industria y los grupos de pacientes han presionado a la FDA para incentivos aún más fuertes. “Ahora, de repente, parece que, guau, esta práctica puede estar aumentando los precios”.
Novartis, propietaria de Gleevec, dijo en un comunicado por correo electrónico que la compañía está avanzando en la investigación y siguiendo a la ciencia para “dar los tratamientos correctos a los pacientes adecuados, basándose en la necesidad no satisfecha, no en el tamaño de la población de pacientes”.
Dos reporteros de KHN pasaron seis meses analizando datos y hablando con legisladores, pacientes, abogados, médicos y compañías para entender cómo ha evolucionado el programa de medicamentos huérfanos de la FDA en medio de un escándalo nacional por el aumento de los precios de los medicamentos. El presidente Donald Trump prometió en la campaña electoral reducir los precios de los medicamentos recetados y durante una conferencia de prensa el 11 de enero dijo que la industria farmacéutica “está saliendo sin culpa del cargo de asesinato”.
La investigación examinó cómo las farmacéuticas utilizan la ley para su beneficio -a menudo con la guía de ex funcionarios de la FDA- y cómo han transformado medicamentos que se pensaba que eran remansos de negocios en uno de los sectores más candentes de la industria farmacéutica.
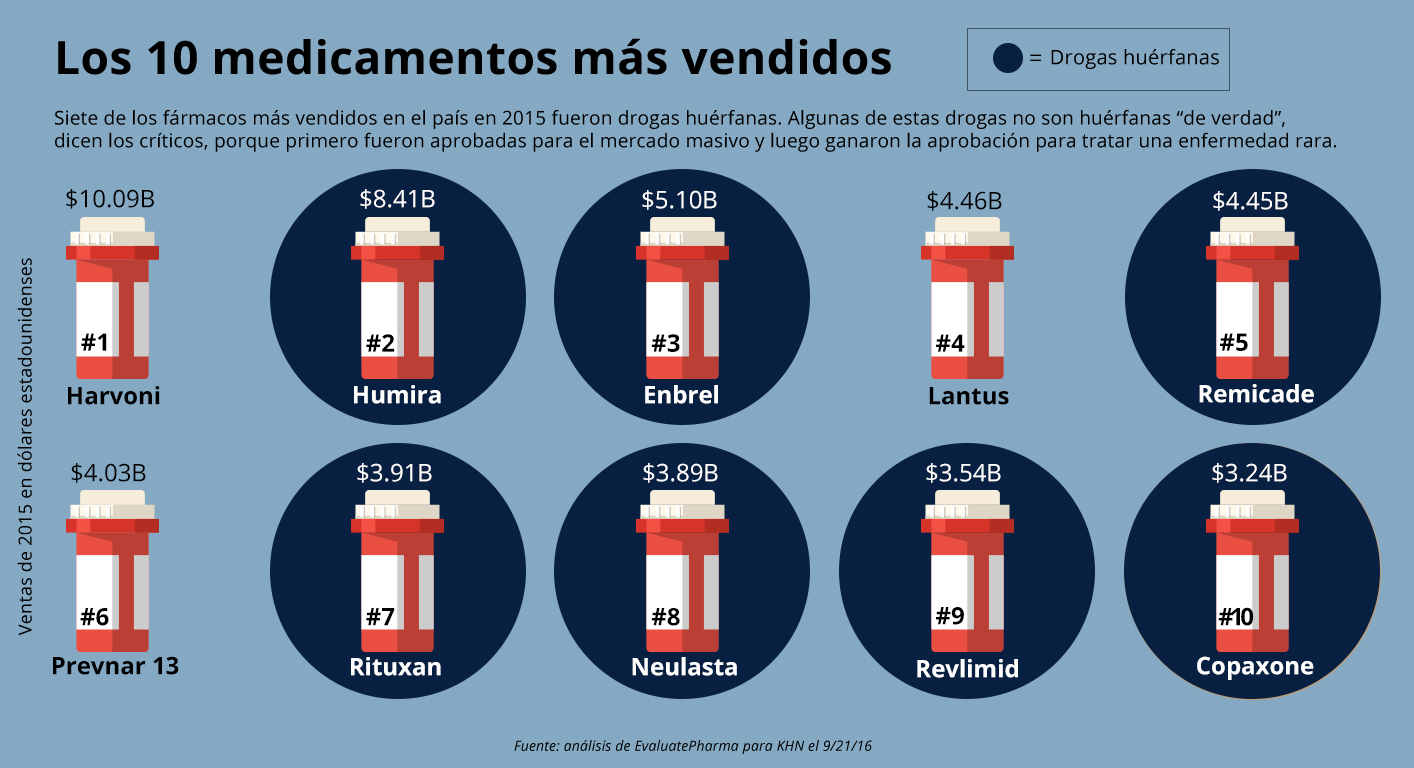
Los medicamentos huérfanos ahora representan siete de los 10 fármacos más vendidos de cualquier tipo, clasificados por ventas anuales, según EvaluatePharma.
“Los huérfanos son malvados”, dijo el doctor Tim Coté, un ex funcionario de la FDA que ahora dirige una consultoría que asesora a fabricantes de medicamentos huérfanos.
Nadie discute que los medicamentos huérfanos han ayudado o salvado a cientos de miles de pacientes que sufren de enfermedades raras debilitantes o incluso mortales. Es difícil de estimar exactamente cuántos porque la FDA no lleva un registro de esa información.
Y los funcionarios de la industria farmacéutica dicen que las empresas deben ser recompensadas, no castigadas, por hacer posible esos tratamientos y por buscar nuevos fármacos que no siempre son un éxito económico.
La investigación y el desarrollo son “largos, costosos, y arriesgados”, dijo Anne Pritchett, vicepresidenta de políticas e investigación del grupo de cabildeo de la industria PhRMA. “Cuando se mira la fibrosis quística, fueron 25 años para el desarrollo de una terapia eficaz… Creo que estaríamos preocupados por cualquier cosa que socavara los incentivos actuales [para los medicamentos huérfanos]”.
El ex representante Henry Waxman, demócrata de California, campeón de la Ley de Medicamentos Huérfanos de 1983, tiene una opinión diferente.
“La Ley de Medicamentos Huérfanos ha sido un gran éxito porque muchas personas que tienen enfermedades que afectan a muy poca gente ahora tienen medicamentos disponibles”, dijo Waxman. “Pero ha sido corrompida si de alguna forma, se convierte en la base de la manipulación del sistema para que la compañía farmacéutica gane mucho más dinero del que haría en un mercado abierto y competitivo”.
Negocio explosivo
En un día de finales del verano, Tim Coté se sentó en una oficina de su empresa de consultoría Coté Orphan, en Sandy Spring, Maryland. Se acercó al micrófono de su computadora para dar información privilegiada sobre el proceso de aprobación de medicamentos huérfanos en un seminario web organizado por FDAnews, una organización comercial de noticias. Los oyentes pagaron alrededor de $300 por cabeza, pero Coté dijo que no recibió un pago por participar.
La FDA es más flexible en la evaluación de los medicamentos para las enfermedades raras, dijo, explicando que “alrededor de la mitad de ellos son aprobados a través de un único ensayo clínico central. No es así para las enfermedades comunes”. La FDA, citando un informe de la Organización Nacional para Trastornos Raros, dijo que aproximadamente dos tercios de los medicamentos huérfanos fueron aprobados con un ensayo adecuado y bien controlado con pruebas de apoyo. Normalmente se requieren dos o tres ensayos de este tipo para aprobar una droga para el mercado masivo.
Coté también le dijo a la audiencia del seminario que los ensayos clínicos para los medicamentos huérfanos suelen ser más pequeños y la aprobación es una “experiencia científica y regulatoria diferente”.
Coté sabe lo que dice. Fue el predecesor inmediato de Rao como jefe de la Oficina de Desarrollo de Productos Huérfanos de la FDA. No es inusual que los funcionarios gubernamentales se vayan de la FDA y otras agencias reguladoras y obtengan empleos como consultores o ejecutivos de la industria.
Coté y otros ex funcionarios de la FDA desempeñan un papel vital ayudando a los farmacéuticos a escoger enfermedades raras y a superar el proceso de aprobación de la agencia federal.

Una pequeña industria artesanal ha crecido en torno a la Ley de Medicamentos Huérfanos. La doctora Marlene Haffner, quien precedió a Coté en la oficina de la FDA para drogas huérfanas, también fundó su propia consultoría para asesorar a pequeñas y grandes empresas sobre aplicaciones de medicamentos huérfanos. Una tercera empresa es Camargo Pharmaceutical Services, dirigida por veteranos de la industria y ex funcionarios de la FDA, que asesora a empresas enfocadas en la reutilización de medicamentos para la aprobación de huérfanos. La firma trata de “estar frente a la FDA muy frecuentemente, tres o cuatro veces al mes”, dijo Jennifer King, directora de marketing de Camargo. Los honorarios por consejería sobre la industria de medicamentos huérfanos varían entre $5,000 y $ 100,000, dependiendo de los servicios que se brinden, dijo Coté.
Pasar por el proceso de aprobación de huérfanos implica una serie de pasos.
En primer lugar, los medicamentos deben ser designados por la FDA como candidatos potenciales para su aprobación. Una empresa tiene que demostrar que su fármaco es un tratamiento prometedor para una enfermedad que afecta a menos de 200.000 pacientes. Si la FDA está de acuerdo y hace la designación formal, se ponen en marcha incentivos financieros, incluyendo un recorte de impuestos del 50% en investigación y desarrollo (I + D) y acceso a subvenciones federales.
Cuando las drogas obtienen la designación de huérfanas, las empresas a menudo cosechan otras recompensas financieras. Las acciones de las empresas que generalmente cotizan en bolsa suben a la luz de la noticia y en ocasiones llegan al 30%. Esto sucede, en parte, porque los huérfanos tienen un historial de tasas de aprobación mucho más altas que los medicamentos para enfermedades comunes.
Hay mucha creatividad detrás de averiguar cómo hacer que una droga sea huérfana.
En el seminario web y en múltiples entrevistas, Coté describió muchas maneras en que las empresas pueden ganar el estatus de huérfana para una droga. Pueden probar sus medicamentos en niños con enfermedades de adultos, como la esquizofrenia, o encontrar medicamentos para enfermedades que no son frecuentes en los Estados Unidos, como la malaria.
“La enfermedad del sueño africana: un problema horrible en África, pero no aquí, no en los EE.UU.”, dijo Coté a su audiencia en el seminario. “Así que un esfuerzo de desarrollo de fármacos dirigidos a algunas de estas enfermedades tropicales puede realmente obtener todos los beneficios de la Ley de Medicamentos Huérfanos”.
“Esta no es una verdadera droga huérfana”
Convertir los medicamentos de mercado masivo en huérfanos ha sido un camino familiar para algunas de las drogas más exitosas.
Humira, de AbbVie, es la droga más vendida del mundo y la mayor parte de sus ventas son en los Estados Unidos, donde los ingresos alcanzaron los $7,600 millones durante el tercer trimestre de 2016 y los $11,800 millones en todo el mundo, según el último informe financiero de la compañía.
Humira fue aprobada por la FDA a finales de 2002 para tratar a millones de personas que sufren de artritis reumatoide. Tres años más tarde, AbbVie solicitó a la FDA que la designara como droga huérfana para tratar la artritis reumatoide juvenil, la cual, dijeron a la FDA, afecta a entre 30,000 y 50,000 estadounidenses. El uso pediátrico fue aprobado en 2008, y Humira posteriormente fue aprobada para cuatro enfermedades raras más, incluyendo Crohn y uveítis, una condición inflamatoria que afecta a los ojos.
La aprobación oftalmológica extendería la exclusividad de mercado para Humira para esa enfermedad en particular hasta 2023. Cuando se le preguntó por qué AbbVie buscó múltiples designaciones y aprobaciones para Humira como huérfana, la compañía se negó a comentar.
Peter Saltonstall, director ejecutivo de la Organización Nacional para Trastornos Raros, dijo que Humira “no es una verdadera droga huérfana”. Pero, agregó, la compañía tiene “la capacidad de salir a obtener la designación de huérfano. Esa es la manera en que la ley se lee ahora … ellos pueden hacer lo que quieran”.
Es difícil decir exactamente cómo, o si la exclusividad de huérfana, afecta el precio de Humira, que es un complejo fármaco biológico y también ha sido protegido por numerosas patentes. La droga ha sido la más vendida de AbbVie por largo tiempo, representando el 63% de sus ingresos, de acuerdo con su presentación financiera más reciente.
En su reciente informe, EvaluatePharma señala que Humira, así como un puñado de otros medicamentos de primera calidad, reciben menos del 25% de sus ventas de usos huérfanos. Sin embargo, si los usos huérfanos de Humira representaran sólo el 10% de las ventas anuales, los ingresos superarían los $1,000 millones.
Rao, de la FDA, dijo que cada nuevo período de exclusividad es específico de una enfermedad y que una vez que se acaba cualquier período de siete años, los genéricos pueden entrar en escena. Gleevec, por ejemplo, obtuvo la aprobación de la FDA para tratar varios tipos de cánceres raros. Todos excepto uno de sus períodos de exclusividad como huérfano habían expirado en 2015, permitiendo que dos genéricos ingresaran al mercado. Pero Gleevec todavía tiene exclusividad hasta 2020 para tratar la leucemia Filadelfia cromosómica linfoblástica aguda positiva recientemente diagnosticada en pacientes que también están en quimioterapia.
También es cierto, explicó Rao, que algunos de los fármacos que pasan por el proceso para ser huérfanos no pueden tratar específicamente una enfermedad rara. Por ejemplo, un medicamento para el cáncer muy tóxico podría no funcionar bien en etapas precoces porque sus riesgos superan los beneficios. Pero la compañía puede proponer que ayudará a un grupo más pequeño de pacientes con cáncer avanzado y obtener la aprobación como huérfano sólo para ese grupo.
En 2013, la FDA aclaró las regulaciones de la Ley de Medicamentos Huérfanos y dijo que quería evitar la posibilidad de que algunas empresas pudieran “potencialmente ‘jugar’ con las aprobaciones sucesivas más estrechas de una droga”.
Salvaguardando el “precio”
Teniendo en cuenta la larga historia de lo que viene pasando, Tim Coté reconoce que hay “algunas lagunas” en la Ley de Medicamentos Huérfanos. Tal vez el 3% o menos de los huérfanos aprobados no cumplen con el “espíritu” de la ley, dijo.
Pero Coté, defensores de enfermedades raras, pacientes y personas de la industria farmacéutica expresaron temor de que cambiar la Ley de Medicamentos Huérfanos, o cuestionar su éxito, perjudicaría el desarrollo de fármacos para pacientes con males raros.
El ex representante Jim Greenwood (republicano por Pennsylvania), actual presidente de la Organización de Innovación en Biotecnología, un grupo comercial de la industria, dijo que las preocupaciones sobre los altos precios de los medicamentos huérfanos no están justificadas. Los incentivos, dijo, no deben ser alterados debido a que las enfermedades raras están “trágicamente matando y brutalizando mayormente a niños”.
Greenwood pareció no darse cuenta de que docenas de aprobaciones huérfanas provenían de la reutilización de drogas de uso masivo, como Humira o Enbrel, otro medicamento desarrollado primero para la artritis reumatoide. Sin embargo, dijo: “Yo diría que el riesgo de perder incentivos en el sistema supera con creces el beneficio de tratar de ahorrar unos cuantos centavos en dólares de la atención médica”.
Es un sentimiento que Coté y otros defensores comparten. Mientras hablaba del costo anual de $311,000 para el fármaco para la fibrosis quística Kalydeco, Coté dijo que cualquier padre cuyo hijo tiene la enfermedad sería un gran admirador de la droga.
“El precio está justificado porque en realidad tiene un efecto dramático sobre los niños. Niños muertos… la gente está dispuesta a pagar mucho para evitarlo”, dijo Coté. “Y es realmente bueno que tengamos esta droga. ¿De acuerdo?”
Kalydeco, el primer fármaco destinado específicamente al defecto bioquímico subyacente de la fibrosis quística, se aprobó para tratar a un subgrupo de pacientes que tienen mutaciones genéticas específicas. El desarrollo de la droga fue financiado por la Fundación de Fibrosis Quística, que vendió sus derechos de regalías de ventas de Kalydeco y otros fármacos contra la fibrosis quística por $3,3 mil millones en 2014.
Otros, entre ellos Henry Waxman, son mucho más críticos y han tratado de hacer algo al respecto a lo largo de los años. Waxman propuso múltiples proyectos de ley para controlar las ganancias de las empresas mediante la enmienda de la ley de drogas huérfanas que patrocinó, pero ninguno tuvo éxito.
La FDA también intentó mantener a las empresas bajo control, pero fracasó.
En 2012, la farmacéutica Depomed Inc. presentó una demanda contra la FDA por negarse a darle a su medicamento Gralise siete años de exclusividad comercial como tratamiento para el dolor relacionado con el herpes zoster (culebrilla).
Rao dijo que la agencia quería ver pruebas de que Gralise era clínicamente superior a otras drogas, señalando que “había un montón de otros genéricos en el mercado” con diferentes formulaciones y requisitos de dosificación. El ingrediente activo de Grasile, la gabapentina, es el mismo que el de Neurontin, la droga éxito de ventas de Pfizer, que también está aprobada para el tratamiento del dolor que causa la culebrilla.
La FDA aprobó Gralise, pero le negó siete años de exclusividad.
En respuesta, la farmacéutica demandó a la agencia y ganó el caso, argumentando que, según la ley, no tenían que probar que su droga era clínicamente superior para ganar el monopolio.
Hoy en día, la droga es uno de los principales productos de Depomed con ventas de $81 millones en 2015. Y en una reciente declaración de representación, Depomed destacó que “proteger la exclusividad de Gralise” era un objetivo corporativo bajo la categoría de “mejorar y proteger el flujo de caja futuro”. Su exclusividad como huérfana termina en 2018. El portavoz de Depomed, Christopher Keenan, dijo que Gralise quería exclusividad de patentes para bloquear la competencia. Pero, agregó Keenan, “si el esfuerzo por patentes hubiera fracasado en todos los frentes, la designación de medicamentos huérfanos habría sido muy importante”.
Después de revisar el análisis de KHN, Rao dijo que quiere entender mejor por qué las farmacéuticas están solicitando múltiples aprobaciones y ha pedido una revisión caso por caso de todas las designaciones de huérfanos otorgadas en 2010 y 2015. Dijo que la agencia carece de los recursos para realizar un análisis de toda la base de datos de fármacos huérfanos.
“Nuestro objetivo es tratar de hacerlo bien”, dijo. “Hay más de 7.000 enfermedades raras, probablemente más, la gran mayoría de las cuales no tienen nada… Quiero asegurarme de que mantenemos la mira en la meta”.
Colaboradores: John Hillkirk, Scott Hensley en NPR, Diane Webber, Marilyn Thompson (editores); Elizabeth Lucas (editora de datos)
Interactivos, video y presentación: Lydia Zuraw, Emily Kopp, Meredith Rizzo en NPR (presentación digital); Francis Ying (videos, gráficos móviles); Heidi de Marco (videos, fotos, audio); Alley Interactive (base de datos)
La cobertura del desarrollo, costos y precios de drogas es apoyada en parte por la Laura and John Arnold Foundation.